1.1.1. Ion, Cation, Anion
Sự tạo thành ion
Nguyên tử luôn trung hòa về điện, nhưng lúc nguyên tử nhường hay nhận thêm electron thì nó phát triển thành phần tử mang trong mình điện gọi là ion.
Sự tạo thành Cation
- Lúc nguyên tử kim loại nhường đi e bên cạnh cùng thì biến thành ion dương (hay Cation).
- Những nguyên tử kim loại lớp bên cạnh cùng có 1,2,3 electron → dễ nhường electron để tạo ra cation (ion dương) có cấu hình bền vững của khí hiếm.
Hình 1: Sự hình thành ion Li+
Li → Li+ + 1e
- Cấu hình electron của Li: 1s22s1, Nguyên tử Li dễ nhường 1 electron tại lớp bên cạnh cùng (1s22s1), phát triển thành ion dương Li+ (1s2)
- Thí dụ:
Na → Na+ + 1e (cation Natri)
Mg → Mg2+ + 2e (cation Magie)
Al → Al3+ + 3e (cation Nhôm)
- Kết luận:
Trong những phản ứng hóa học, để đạt cấu hình electron bền của khí hiếm nguyên tử kim loại có khuynh hướng nhường e cho nguyên tử nguyên tố khác để phát triển thành ion dương, gọi là cation.
Tổng quát: M → Mn+ + ne
Sự tạo thành Cation
- Lúc nguyên tử phi kim nhận thêm electron thì biến thành ion âm (hay Anion).
- Những nguyên tử phi kim lớp bên cạnh cùng có 5,6,7e có khả năng nhận thêm electron và biến thành anion (ion âm) có cấu hình bền vững của khí hiếm.
Hình 2: Sự hình thành ion F-
F + 1e → F-
-
Cấu hình e của nguyên tử F : 1s2 2s2 2p5
-
Do có 7e lớp bên cạnh cùng nên Flo có xu hướng nhận thêm 1e để đạt được cấu hình bền vững của khí hiếm Ne
Hình 3: Sự hình thành ion Cl-
Cl + 1e → Cl-
- Thí dụ: O + 2e → O2-
- Kết luận:
Trong những phản ứng hóa học, để đạt cấu hình electron bền của khí hiếm nguyên tử phi kim có khuynh hướng nhận e từ nguyên tử những nguyên tố khác để phát triển thành ion âm, gọi là anion.
Tổng quát: A + ne → An-
1.1.2. Ion đơn nguyên tử Và Ion Đa nguyên tử
Ion đơn nguyên tử
- Là những ion tạo nên từ 1 nguyên tử.
- Thí dụ: Cation: Na+, Ca2+… Anion: Cl- ,S2- …
Ion đa nguyên tử
- Là những nhóm nguyên tử mang trong mình điện tích dương hay âm.
- Thí dụ: Cation: NH4+ … Anion: SO42-, OH-…
Thí dụ: Xét phân tử NaCl
- Nguyên tử Na nhường 1e cho nguyên tử Cl để biến thành ion dương Na+.
Na → Na+ + 1e
- Từng nguyên tử Cl nhận 1e để biến thành ion âm Cl-
Cl + 1e → Cl-
Hình 4: Quy trình hình thành hợp tác ion giữa Natri và Clo
- Hợp tác ion là hợp tác được hình thành bởi lực hút tĩnh điện giữa những ion mang trong mình điện trái dấu.
- Phản ứng hóa học: 2Na + Cl2 → 2 NaCl
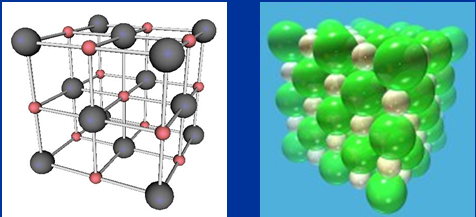
1.3.1. Tinh thể NaCl
-
Trên thể rắn, NaCl tồn tại dưới dạng tinh thể. Trong mạng tinh thể NaCl những ion Na+,Cl- được phân bố luân phiên đều đặn và có trật tự động trên những đỉnh của hình lập phương bé. Xung quanh từng ion đều có 6 ion ngược dấu hợp tác sở hữu nó.
Hình 5: Tinh thể ion NaCl
1.3.2. Tính chất chung của hợp chất ion
- Tinh thể ion siêu bền vững vì lực hút tĩnh điện giữa những ion ngược dấu trong tinh thể lớn. Những hợp chất ion đều khá rắn, khó nóng chảy, khó bay tương đối.
- Những hợp chất ion thường tan nhiều trong nước. Lúc nóng chảy, lúc hòa tan trong nước chúng tạo thành dung dịch dẫn được điện, còn tại trạng thái rắn thì ko dẫn được điện.