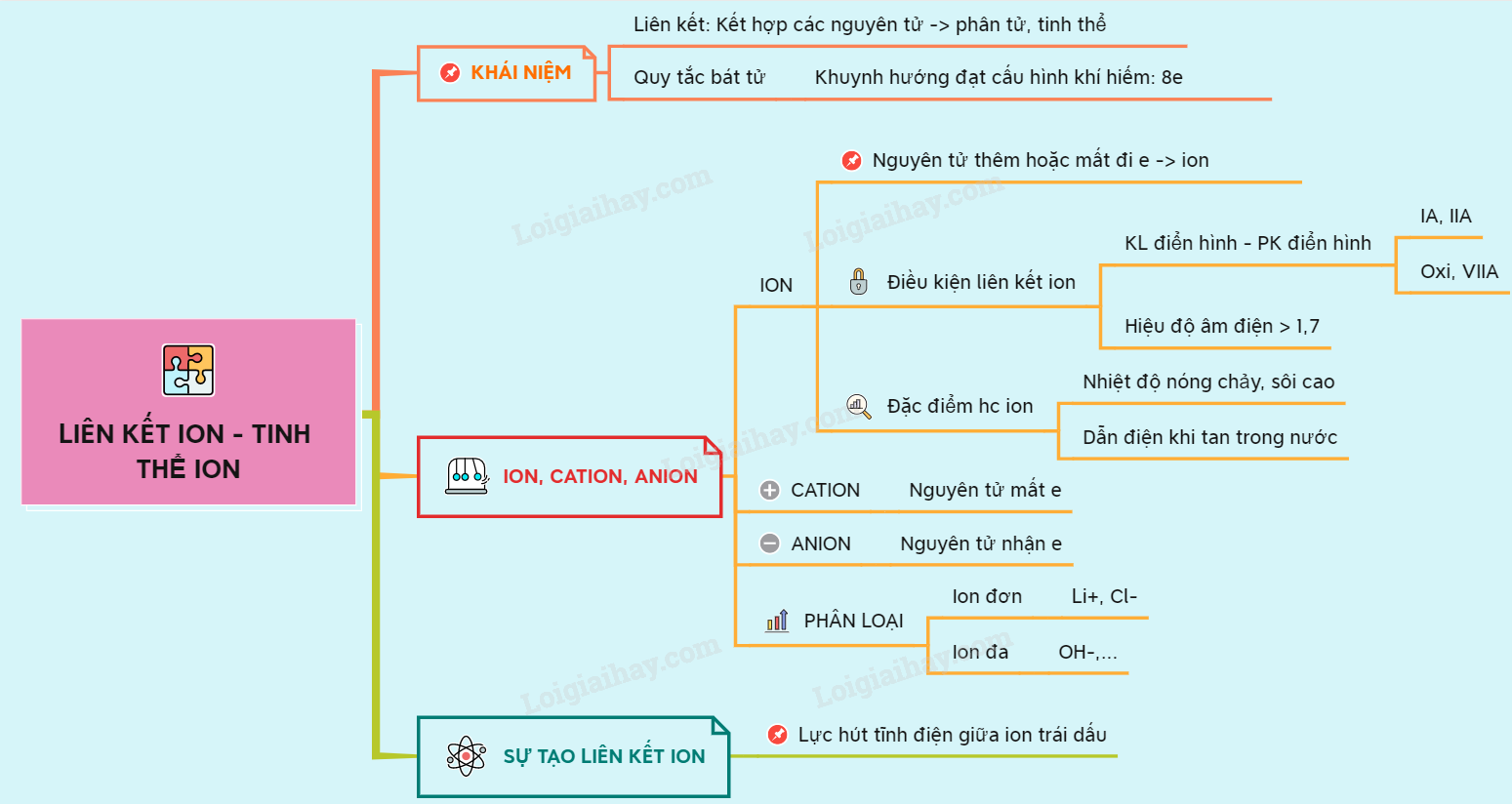
I. KHÁI NIỆM VỀ LIÊN KẾT HÓA HỌC
1. Khái niệm về hợp tác
Trừ trường hợp những khí hiếm, tại điều kiện bình thường những nguyên tử của những nguyên tố ko tồn tại tại trạng thái tự động do, riêng rẽ mà hợp tác sở hữu những nguyên tử khác nhau tạo thành phân tử hay tinh thể.
=> Hợp tác hóa học là sự hài hòa giữa những nguyên tử để tạo thành phân tử hay tinh thể bền vững hơn.
2. Quy tắc bát tử (8 electron)
Theo quy tắc bát tử thì những nguyên tử của những nguyên tố có khuynh hướng hợp tác sở hữu những nguyên tử khác để đạt cấu hình vững bền của những khí hiếm sở hữu 8 electron (hoặc 2 electron sở hữu heli) tại lớp bên cạnh cùng.
II. SỰ TẠO THÀNH LIÊN KẾT ION, ANION, CATION
1. Sự tạo thành ion.
– Trong phản ứng hóa học, lúc nguyên tử, phân tử thêm hoặc mất bớt electron nó sẽ tạo thành những phần tử mang trong mình điện được gọi là ion. Những ion trái dấu hút nhau bằng lực hút tĩnh điện tạo thành hợp chất chứa hợp tác ion.
– Điều kiện hình thành hợp tác ion:
+ Hợp tác được hình thành giữa những nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
+ Quy ước hiệu độ âm điện giữa 2 nguyên tử hợp tác ≥ 1,7 là hợp tác ion (trừ 1 số trường hợp).
– Dấu hiệu cho thấy phân tử có hợp tác ion:
+ Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim điển hình (phi kim nhóm VIIA và Oxi).
Dí dụ: Những phân tử NaCl, MgCl2, BaF2,…đều chứa hợp tác ion, là hợp tác được hình thành giữa những cation kim loại và anion phi kim.
+ Phân tử hợp chất muối chứa cation hoặc anion đa nguyên tử.
Dí dụ: Những phân tử NH4Cl, MgSO4, AgNO3,… đều chứa hợp tác ion, là hợp tác được hình thành giữa cation kim loại hoặc amoni và anion gốc axit.
– Đặc điểm của hợp chất ion: Những hợp chấy ion có nhiệt độ nóng chảy và nhiệt độ sôi cao, dẫn điện lúc tan tròn nước hoặc nóng chảy.
– Ion được chia thành cation và anion:
Cation : Ion dương
Anion : Ion âm
2. Sự tạo thành cation
– Ion mang trong mình điện tích dương gọi là ion dương hay cation.
– Ví dụ những nguyên tử nhường bớt electron lúc tham dự phản ứng hóa học nó sẽ phát triển thành những phần tử mang trong mình điện tích dương hay còn gọi là cation.
Dí dụ: Sự hình thành Cation của nguyên tử Li(Z=3)
Cấu hình e: 1s22s1
1s22s1 → 1s2 + 1e
(Li) (Li+)
Hay: Li → Li+ + 1e
Li+ gọi là cation liti
3. Sự tạo thành anion
– Ion mang trong mình điện tích âm gọi là ion âm hay anion.
– Ví dụ những nguyên tử nhận thêm electron lúc tham dự phản ứng hóa học nó sẽ phát triển thành những phần tử mang trong mình điện tích âm hay còn gọi là anion.
Dí dụ: Sự hình thành anion của nguyên tử F(Z=9)
Cấu hình e: 1s22s22p5
1s22s22p5 + 1e → 1s22s22p6
(F) (F-)
Hay: F + 1e → F-
F-gọi là anion florua
4. Ion đơn nguyên tử và ion âm đa nguyên tử
– Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử .
Thí dụ: cation Li+, Na+, Mg2+và anion F-, Cl-…….
– Ion đa nguyên tử là những nhóm nguyên tử mang trong mình điện tích dương hay âm .
Thí dụ: cation amoni NH4+, anion hidroxit OH-, anion sunfat SO42-, …….
III. Sự tạo thành hợp tác ion
– Hợp tác ion là hợp tác được hình thành bởi lực hút tĩnh điện giữa những ion mang trong mình điện tích trái dấu.
Dí dụ: Na+ + Cl- → NaCl
=> Hợp tác giữa cation Na+ và anion Cl- là hợp tác ion.
Video mô phỏng – Hợp tác ion
Sơ đồ tư duy: Hợp tác ion – tinh thể ion
Loigiaihay.com
